dr Łukasz Januszkiewicz
Znajomość anatomii układu żylnego serca pacjenta jest kluczowa dla powodzenia zabiegu implantacji układu do resynchronizacji. Problemy z zacewnikowaniem samej zatoki wieńcowej, przejściem przez zastawkę Vieussensa czy implantacją elektrody lewokomorowej do docelowej bocznicy nie należą do rzadkości. W niniejszym artykule przedstawiono anatomię żył serca w kontekście terapii resynchronizującej (ang. CRT, cardiac resynchronization therapy).
Budowa żył serca
Zatoka wieńcowa jest największym i najbardziej stałym naczyniem żylnym serca. Jej długość wynosi zwykle 3-5,5 cm, podczas gdy ujście ma średnicę najczęściej w granicach 0,5-1,5 cm. Zatoka wieńcowa leży w bruździe wieńcowej między lewym przedsionkiem i lewą komorą. Powstaje z żyły wielkiej serca, od której bywa oddzie-lona zastawką Vieussensa. Granicę między zatoką wieńcową a żyłą wielką serca stanowi żyła Marshalla, nazywana inaczej żyłą sko-śną lewego przedsionka. Ujście zatoki wieńcowej znajduje się w tylnej części przegrody międzyprzedsionkowej, w stronę tylną od pierścienia zastawki trójdzielnej, i może być częściowo zamknięte przez przeważnie pół-księżycowatą zastawkę Tebezjusza.
W bruździe międzykomorowej przed-niej, obok gałęzi przedniej zstępującej lewej tętnicy wieńcowej, leży żyła przednia międzykomorowa. Zbiera ona krew z okolicy koniuszka lewej komory. Po dotarciu do podstawy serca idzie dalej w bruździe przedsionkowokomorowej i tworzy żyłę wielką serca, która przechodzi następnie w zatokę wieńcową. Tuż w okolicy ostium zatoki wieńcowej do prawego przedsionka uchodzi żyła średnia serca. Znajduje się ona w bruździe międzykomorowej tylnej. Żyła średnia serca to największy proksymalny dopływ zatoki wieńcowej. Zdarza się, że żyła średnia serca uchodzi bezpośrednio do prawego przed-sionka. Bocznie od żyły średniej serca znajdują się żyły tylnoboczne, wśród których najczęściej poszukuje się optymalnego miejsca stymulacji lewokomorowej w CRT1, 2. Na rycinach 1 i 2 przedstawiono anato-mię układu żylnego serca.

Rycina 1. Schemat układu żylnego serca
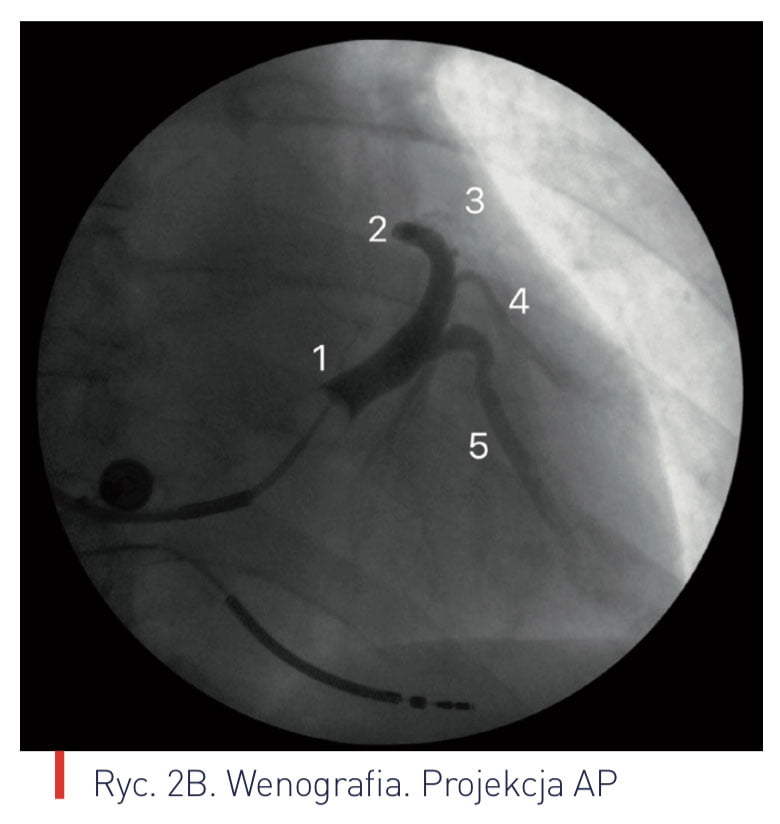
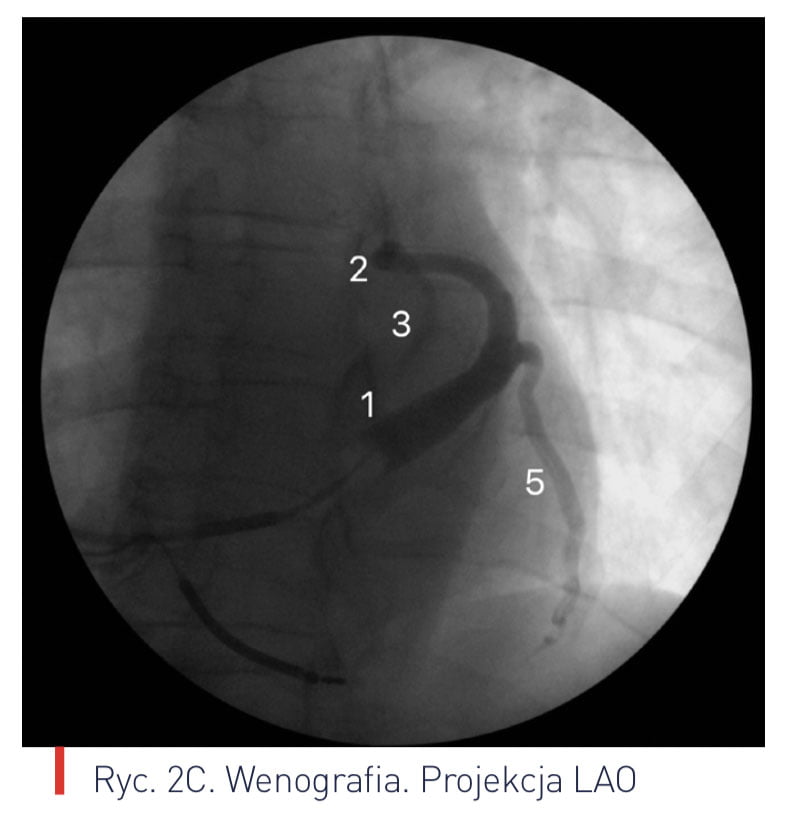
1 ? zatoka wieńcowa
2 ? żyła wielka serca
3 ? żyła przednia międzykomorowa
4 ? żyła brzeżna lewa
5 ? żyła tylno-boczna
6 ? żyła średnia serca
7 ? żyła mała
8 ? żyła skośna lewego przedsionka
Ryciny 2. Wenografia
A Projekcja RAO
przednia międzykomorowa 4 ? żyła brzeżna lewa
5 ? żyła tylno-boczna
6 ? żyła średnia serca
B Projekcja AP
C Projekcja LAO
Legenda:
1 ? zatoka wieńcowa
2 ? żyła wielka serca
Trudności w implantacji
Pierwszą trudność w implantacji elektrody lewokomorowej może stanowić już sama kaniulacja zatoki wieńcowej. Trzy podstawowe zmienne mogą mieć istotny wpływ na trudność zacewnikowania zatoki wieńcowej: powierzchnia ujścia zatoki, kąt ujścia zatoki wieńcowej do prawego przedsionka i obecność zastawki Tebezjusza3. Według wyników badań post mortem zastawka Tebezjusza jest obecna w 62-85% przypadków4, 5. Istnieje duża zmienność morfologiczna typów tej zastawki. Szacuje się, że w kilkunastu procentach przypadków pacjentów z zastawką Tebezjusza jej kształt może utrudniać cewnikowanie zatoki wieńcowej.
Hołda i wsp. na podstawie analizy 273 ludzkich serc post mortem zaproponowali nową klasyfikację zastawek Tebezjusza6. Wyróżniono zastawki: resztkowe, półksiężycowate, zakrywające prawie całe ujście zatoki, ze struną, fenestrowane i siatkowane. Za-stawka Tebezjusza była obecna w 82,1% przy-padków. Najczęściej występował typ półksiężycowaty (32,6%), rzadziej resztkowy (25,5%) czy zakrywający prawie całe ujście (17,4%). W siedmiu przypadkach (2,6%) zastawka Tebezjusza całkowicie pokrywała ujście za-toki wieńcowej, czyniąc zacewnikowanie naczynia ekstremalnie trudnym, co, zdaniem autorów, mniej więcej zgadza się z odsetkiem niepowodzeń kaniulacji zatoki obserwowa-nym w pracach klinicznych. Dodatkowo stwierdzono, że ujścia zatok z zastawką Tebe-zjusza były mniejsze niż ujścia zatok bez niej (odpowiednio: 11,6?3,3 mm vs. 15,1?3,1 mm, p < 0,001).
W innej pracy post mortem, w której przeanalizowano 620 serc, zastawkę Tebezju-sza obserwowano w 63% przypadków7. Jedynie w 6% przypadków zastawka Tebezjusza pokrywała > 70% ostium zatoki wieńcowej. Zastawka Vieussensa była obecna w 8%, a tylko w 1% zastawka zamykała prawie całe światło naczynia.
W tej samej pracy w 95 preparatach był zachowany lewy nerw przeponowy. W 45% przypadków przechodził on przez środkowy segment ściany bocznej lewej komory ? jeden z docelowych obszarów stymulacji w CRT.
W kolejnej pracy Mazur i wsp. ocenili zmienność dopływów zatoki wieńcowej na 200 ludzkich sercach badanych post mortem pod kątem zabiegów implantacji CRT8. Żyła średnia była najbardziej stałym dopływem zatoki wieńcowej i występowała we wszystkich przypadkach. Obserwowano dużą zmienność w liczbie i morfologii żył tylnobocznych. Pojedyncza żyła tylnoboczna była obecna w 63,5% przypadków i miała dogodny do implantacji elektrody, rozwarty kąt ujścia do zatoki wieńcowej. W 30,5% przypadków była więcej niż jedna żyła tylnoboczna. Wówczas ich średnica była zwykle mniejsza niż pojedynczej żyły tylnobocznej. Żyła brzeżna lewa występowała jedynie w 40% przypadków. Ponadto jej światło było zwykle dość małe (w 36,7% przypadków > 3-Fr), a dodatkowo ostry kąt odejścia obecny w 59,5% przypadków może utrudniać jej kaniulację. Autorzy podsumowali pracę, pisząc m.in., że żyły dolnoboczne są bardzo zmienne w zakresie liczby, ale ich morfologia sprawia, że są odpowiednie do implantacji elektrody lewokomorowej.
Boonyasirinant i wsp. porównali w tomografii komputerowej liczbę odpowiednich bocznic do implantacji elektrody lewokomorowej w CRT u 100 pacjentów: 25 poddanych operacji pomostowania aortalnowieńcowego z obniżoną frakcją wyrzutową, 25 poddanych operacji pomostowania aortalnowieńcowego z zachowaną frakcją wyrzutową, 25 z kardiomiopatią nieniedokrwienną i 25 z grupy kontrolnej9. Żyły tylnoboczne i żyła brzeżna lewa były obecne odpowiednio: u 68% i 48% z grupy pomostowania aortalnowieńcowego z obniżoną frakcją wyrzutową, u 96% i 68% osób po pomostowaniu aortalnowieńcowym z zachowaną frakcją wyrzutową, 92% i 80% osób z kardiomiopatią nieniedokrwienną oraz 100% i 80% z grupy kontrolnej. Było to pierwsze badanie, które wykazało istotne różnice w występowaniu żył, które najczęściej uznawane są jako optymalne do stymulacji lewokomorowej. Wydaje się, że obserwowane wyniki mogą częściowo tłumaczyć niższy odsetek osób odpowiadających na CRT w grupie z kardio-miopatią niedokrwienną.
Do podobnych wniosków doszli naukowcy z Seulu, badając wenografie 75 pacjentów podczas implantacji CRT10. Oceniono średnicę i kąty odejścia żył bocznych i tylnych. Za łatwo dostępne uznano naczynia o średnicy ? 1,6 mm uchodzące pod kątem ? 90°. Okazało się, że w grupie osób z kardiomiopatią nieniedokrwienną ż 96,4% żył bocznych i tylnych uznano za łatwo dostępne, podczas gdy w kohorcie pacjentów z kardiomiopatią niedokrwienną odsetek ten wyniósł 68,4% (p = 0,003). W analizie płci wykazano, że żyły boczne i tylne o łatwej dostępności częściej występowały u kobiet niż u mężczyzn (79,8% vs. 68,3%, p = 0,035). To kolejne, ważne wnioski, które mogą pomóc wyjaśnić obserwowane od lat różnice w odpowiedzi na CRT.
Jak poprawić skuteczność CRT?
Nie ulega wątpliwości, że na efektywność CRT i długoterminowe korzyści dla pacjentów wpływa właściwa kwalifikacja, skuteczny zabieg i odpowiednie progra-mowanie układu. Po zakwalifikowaniu pacjenta do implantacji CRT należy dołożyć wszelkich starań, by miejsce stymulacji elektrody lewokomorowej było jak najlepsze dla chorego. Identyfikacja optymalnej bocznicy może zostać ułatwiona przez wykonanie wenografii rotacyjnej, podczas której uzyskuje się trójwymiarowy obraz drzewa żylnego po jednoczasowym podaniu kontrastu i ruchu ramienia C po 110-stopniowym łuku. Taka metoda pozwoliła na znalezienie optymalnych żył do implantacji elektrody lewokomorowej u 100% pacjentów w po-równaniu z klasyczną wenografią, w ramach której wykonywano zdjęcie w projekcji RAO 45° i LAO 45° (w tym przypadku udawało się znaleźć optymalną żyłę w 74% przy-padków). W innej pracy nałożenie obrazu zatoki wieńcowej i jej dopływów uzyskane w tomografii komputerowej wykonanej przed zabiegiem na obraz wenografii śródzabiegowej pozwoliło na skuteczniejszą implantację elektrody lewokomorowej i skrócenie czasu fluoroskopii w porównaniu ze standardowym postępowaniem12.
Wydaje się, że zalecane w wytycznych segmenty inne niż koniuszkowe ściany bocznej nie zawsze muszą być najlepszym miejscem stymulacji lewej komory u wszystkich pacjentów kwalifikowanych do CRT. Rośnie liczba dowodów wskazujących na zasadność unikania stymulacji w okolicy blizny w lewej komorze. Dodatkowo, wyższą odpowiedź na CRT obserwuje się w przypadku implantacji elektrody lewokomorowej w miejsce o najpóźniejszej aktywacji lewej komory, którego położenie jest wysoce zmienne osobniczo. Dlatego, biorąc pod uwagę wyżej wymienione informacje, wydaje się, że integracja danych z różnych metod obrazowania serca może pomóc w wyborze indywidualnego, optymalnego miejsca stymulacji lewej komory. Takie działania zastosowali naukowcy z Maastricht u 16 kandydatów do implantacji CRT13. Stworzyli oni trójwymiarowy model serca, integrując obrazy uzyskane z angio-CT, rezonansu magnetycznego i elektrokardiografii. Angio CT pozwoliło na wizualizację drzewa żylnego serca, rezonans magnetyczny zidentyfikował obszary blizny, a elektrokardiografia zarejestrowana przez 184 elektrody pokazała dokładne rozchodzenie się impulsów w sercu. Dzięki temu u sześciu pacjentów udało się znaleźć jedną żyłę poza obszarem blizny, w miejscu późnej aktywacji miokardium, u pięciu pacjentów ? dwie takie żyły, a u pozostałych pięciu osób nie było takiej żyły. Ostatecznie u 11 z 14 pacjentów udało się implantować elektrodę w miejscu późnej aktywacji mięśnia sercowego poza blizną. U trzech chorych wszczepienie elek-trody lewokomorowej w obszar blizny było nieuniknione. Jest to kolejny krok w kierunku indywidualizacji CRT u pacjentów z niewydolnością serca.
Waga znajomości anatomii żył serca
Znajomość anatomii układu żylnego serca jest ważna dla lekarzy implantujących CRT. Wiedza na temat możliwych odmien-ności anatomicznych i wariantów utrudniających implantację elektrody lewokomorowej może pomóc w lepszym przygotowaniu do zabiegu i wcześniejszym wyborze optymalnego sprzętu. Wydaje się, że w przyszłości coraz większe znaczenie może mieć połączenie danych z różnych form obrazowania, co może pomóc zindywidualizować CRT dla konkretnego pacjenta.
Bibliografia
- Spencer J.H., Anderson S.E., Iaizzo P.A.: Human coro-nary venous anatomy: implications for interventions. J Cardiovasc Trans Res 2013; 6: 208-17.
- Habib A., Lachman N., Christensen K.N., Asirvatham S.J.: The anatomy of the coronary sinus venous system for the cardiac electrophysiologist. Europace 2009; 11: v15-v21.
- Mlynarski R., Mlynarska A., Tendera M., Sosnowski M.: Coronary sinus ostium: the key structure in the heart?s anatomy from the electrophysiologist?s point of view. Heart Vessels 2011; 26:449-56.
- Gami A.S., Edwards W.D., Lachman N. i wsp.: Electrophysiological anatomy of typical atrial flutter: the posterior boundary and causes for difficulty with abla-tion. J Cardiovasc Electrophysiol 2010; 21:144-9.
- Hellerstein H.K., Orbison J.L.: Anatomic variations of the coronary sinus ostium area of the human heart. J Int Med Res 2008; 36:314-21.
- Hołda M.K., Klimek-Piotrowska W., Koziej M., Mazur M.: Anatomical variations of the coronary sinus valve (Thebesian valve): implications for electrocardiological procedures. Europace 2015; 17:921-7.
- Noheria A., Desimone C.V., Lachman N. i wsp.: Ana-tomy of the coronary sinus and epicardial coronary venous system in 620 hearts: an electrophysiologic perspective. J Cardiovasc Electrophysiol 2013; 24:1-6.
- Mazur M., Żabówka A., Bolechała F. i wsp.: Variations and angulation of the coronary sinus tributaries: Impli-cations for left ventricular pacing. Pacing Clin Electro-physiol 2019; 1-8 doi: 10.111/pace.13618.
- Boonyasirinant T., Halliburton S.S., Schoenhagen P. i wsp.: Absence of coronary sinus tributaries in ischemic cardiomyopathy: an insight from multidetec-tor computed tomography cardiac venographic study. J Cardiovasc Comput Tomography 2016; 10:156-61.
- Uhm J-S., Park J.W., Lee H. i wsp.: Cardiac vein accessi-bility according to heart diseases and sex: implications for cardiac resynchronization therapy. PACE 2016; 39:513-21.
- Blendea D., Mansour M., Shah R.V. i wsp.: Usefulness of high-speed rotational coronary venous angiography during cardiac resynchronization therapy. Am J Cardiol 2007; 100:1561-5.
- Alikhani Z., Li J., Merchan J.A. i wsp.: Coronary sinus anatomy by computerized tomography, overlaid on live fluoroscopy can be successfully used to guide left ventricular lead implantation: a feasibility study. J In-terv Card Electrophysiol 2013; 36:217-22.
- Nguyen U.C., Cluitmans M.J.M., Strik M. i wsp.: In-tegration of cardiac magnetic resonance imaging, electrocardiographic imaging, and coronary venous computed tomography angiography for guidance of left ventricular lead positioning. Europace 2018; doi:10.1093/europace/euy292.